Syndrom suchego oka u psów i kotów w aspekcie klinicznym
2020-07-10 11:00:00
Syndrom suchego oka u psów i kotów w aspekcie klinicznym – ocena skuteczności weterynaryjnego preparatu łzozastępczego VisioPet.
Gałka oczna jest narządem wrażliwym, narażonym na działanie licznych zewnętrznych czynników fi zycznych. Za ochronę powierzchni oka odpowiedzialny jest aparat powiekowy oraz tzw. przedrogówkowy film łzowy (PFŁ) pokrywający rogówkę i spojówkę. Złożony skład przedrogówkowego fi lmu łzowego zapewnia jego funkcjonalność polegającą na utrzymaniu nawilżenia rogówki.
Zewnętrzna, lipidowa warstwa fi lmu łzowego o grubości około 0,1 μm odpowiedzialna jest za ograniczenie odparowywania oraz za związanie PFŁ z rogówką na styku z brzegami powiekowymi, a także za zapobieganie wylewu łez z worka spojówkowego poprzez zwiększenie napięcia powierzchniowego. Składa się ona z lipidów, fosfolipidów i jest widoczna podczas badania biomikroskopowego, w świetle spolaryzowanym.
Środkowa, wodnista warstwa PRŁ, o grubości ok 7μm składa się głównie z wody. Jej zasadnicze funkcje to: wypłukiwanie zanieczyszczeń i czynników mikrobiologicznych; odżywienie rogówki poprzez dostarczanie zawieszonych w niej substancji (witaminy, tlen, czynniki wzrostu); ochrona immunologiczna (zawartość przeciwciał, laktoferyny, lizozymu, krwinek białych, inhibitorów proteaz); zapewnienie ruchomości powiek poprzez ich nawilżenie.
Warstwa wewnętrzna, mucynowa (1–2 μm) ma za zadanie wiązanie warstwy wodnistej z litofi lną powierzchnią rogówki. [1]
Zespół suchego oka (ZSO) – keratoconjunctivitis sicca (KCS), obejmuje grupę chorób o różnej etiologii i mechanizmach powstawania, których wspólnym mianownikiem jest obecność zaburzeń funkcji przedrogówkowego fi lmu łzowego, powodujących uporczywe dolegliwości oraz prowadzących do powstania zmian patologicznych na powierzchni oka. [1,2,3]
W zależności od patomechanizmu prowadzącego do rozwoju KCS, można wyodrębnić dwie główne jego kategorie, tj.: przebiegającą z obniżoną objętością wydzielania łez, (głównie ich składowej wodnistej) – ATD (obniżona objętość wydzielania łez; ang. Aquous tear defi ciency) , oraz przebiegającą z nadmiernym parowaniem fi lmu łzowego, głównie na skutek nieprawidłowości w jakości i ilości warstwy tłuszczowej PFŁ - EDE (nadmierne parowanie fi lmu łzowego; ang. Evaporative dry eye). [2]
W niektórych stanach chorobowych, jak np.: w znaczącym niedoborze witaminy A, po oparzeniach, czy w polekowym toksycznym uszkodzeniu nabłonka spojówek, możliwe jest także wystąpienie zaburzeń funkcji komórek kubkowych spojówki, uczestniczących w produkcji warstwy śluzowej filmu łzowego (mucin deficiency) prowadzące do niedostatecznego nawilżenia powierzchni rogówki oraz uszkodzenia jej nabłonka, nawet przy zachowaniu prawidłowego wydzielania składowej wodnistej łez oraz odpowiedniej ilości i funkcjonalności warstwy tłuszczowej.
Należy pamiętać, że w wielu przypadkach KCS patomechanizm zaburzeń funkcjonowania filmu łzowego ma charakter mieszany, wynikający ze złożonych powiązań poszczególnych elementów aparatu ochronnego i powierzchni oka. [1,2]
U psów krótkoczaszkowych częstym problemem jest upośledzenie tzw. indeksu mrugnięć, powodujące nieprawidłowe rozprowadzanie w pełni funkcjonalnego i prawidłowego PFŁ, czego konsekwencją są również objawy KCS. Podobnym problemem jest wpływ leków anestetycznych podczas znieczulenia ogólnego pacjentów. Zastosowanie narkozy powoduje unieruchomienie powiek w pozycji rozwartej, a co za tym idzie uniemożliwienie prawidłowego nawilżania gałki ocznej.
Najczęstsze przyczyny KCS u psów i kotów można sklasyfikować w kilku kategoriach:
Polekowe: Sulfonamidy (sulfadiazyna, sulfasalazyna) powodujące uszkodzenie komórek groniastych gruczołu łzowego; [1,2] Fenazopirydyna; Mydriatyki – cykloplegiki (atropina, tropicamid); Niektóre leki przeciwjaskrowe [3,5]. Leki przeciwhistaminowe, obniżające ciśnienie tętnicze, obkurczające naczynia, efedryna, pseudoefedryna, metoclopramid, chlorpromazyna i inne pochodne fenotiazyny. [2]
Jatrogenne: Częste, udokumentowane powikłanie częściowego lub całkowitego usunięcia gruczołu trzeciej powieki z powodu jego wypadnięcia. [1,3,6]. Średni czas wystąpienia KCS po takim zabiegu to około 4,5 roku, przy czym pewne zaburzenia składu łez widoczne są nawet w ciągu kilkudziesięciu dni po operacji. Możliwe jest również wystąpienie KCS po zabiegu usunięcia przewodu słuchowego na skutek uszkodzenia nerwu twarzowego [1]
Immunologiczne: Najczęstsza przyczyna KCS u psów [1]. Powodem uszkodzenia jest obecność przeciwciał skierowanych przeciwko gruczołowi łzowemu.
Pourazowe: Uszkodzenia dotyczące bezpośrednio gruczołu lub jego unerwienia. Możliwe jest też wystąpienie KCS u psów z wytrzeszczem wtórnym do wypadnięcia gałki ocznej.
Zakaźne: Nosówka; lejszmanioza; zakażenie Feline Herpes Virus typ 1 (FHV1), powodujące włóknienie przewodzików łzowych; Zakażenia bakteryjne i wirusowe samej tkanki gruczołowej. Powikłania chorób pozaukładowych: M.in. nadczynność kory nadnerczy, choroby metaboliczne (cukrzyca).
Wrodzone: Jako skutek niedorozwoju nabłonka groniastego (Mops; Yorkshire terrier; Chihuahua; Bulldog angielski). Zanik starczy gruczołu, radioterapia to możliwe inne przyczyny KCS.
Objawy: Objawy kliniczne zależne są od tego, czy problem jest jedno-, czy obustronny, oraz jego charakteru (ostry lub przewlekły). Typowe objawy KCS to: mrużenie powiek, sugerujące dyskomfort i ból; nadwrażliwość na światło ze szczególnym nasileniem lub w porach wieczornych. Nasilenie objawów może mieć również związek z działaniem czynników zewnętrznych, takich jak zapylenie, suche powietrze (szczególnie w sezonie grzewczym), dym, pyły zawieszone, niektóre leki. Charakterystyczne jest również wyeksponowanie trzeciej powieki. Często pojawia się podrażnienie, przekrwienie a następnie zapalenie spojówek. Typowym objawem zaawansowanych postaci KCS jest obecność szarobiałej, budyniowatej wydzieliny zasychającej na brzegach powiekowych oraz wystąpienie zmian zapalnych i degeneracyjnych w rogówce. [1,3,4,] Wydzielina może być jałowa lub septyczna – wtedy najczęściej jej barwa zmienia się na żółtawą lub zielonkawą. W cięższych przypadkach dochodzi do utraty nabłonka rogówki (szczególnie w części centralnej) i wtórnego zapalenia błony naczyniowej oka.
Rozpoznanie KCS stawia się na podstawie danych z wywiadu, badania klinicznego oraz testów pomocniczych. Podczas badania w biomikroskopie (lampie szczelinowej) zauważalne są: przerywany, obniżony menisk łzowy na brzegu dolnej powieki; obecność fałdów spojówki, filamenty, złuszczone resztki nabłonka, zadrażnienie spojówek, zmiany zapalne i degeneracyjne w spojówce i rogówce, do zgrubienia, neowaskularyzacji i pigmentacji włącznie.
Ocena stabilności filmu łzowego w testach dodatkowych: Metoda oceny przerwania filmu łzowego przy użyciu barwnika fluoresceinowego - FBUT (fluoresceine break-up time) – pomiar czasu przerwania filmu łzowego od mrugnięcia do pojawienia się na rogówce ciemnych linii rozpadu warstwy łez; wynik nieprawidłowy – poniżej 10 s. Wskazane wykonanie minimum trzech pomiarów i obliczenie średniej. Jest to test bardzo czuły, jednak mało powtarzalny, ze względu na ingerencję fluoresceiny w naturalny skład filmu łzowego.
Ocena powierzchni oka za pomocą testów barwnych fluoresceina (badanie w świetle ciepłym oraz z filtrem kobaltowym) -– w średnio i silnie nasilonym KCS wykazuje punktowate ubytki nabłonka rogówki, czasami głębsze erozje i owrzodzenia
Ocena wydzielania gruczołów łzowych Test Schirmera – polega na założeniu pod powiekę części bibułki z podziałką milimetrową. Gdy łzy w ciągu minuty zamoczą mniej niż 10 mm bibułki, możemy stwierdzić, ż e pacjent cierpi na KCS. Wynik powyżej 15 mm mówi, że w badanym oku produkcja i wydzielanie łez są na prawidłowym poziomie [1,2]. Gdy uzyskany na skali wynik zawiera się w granicach 10–15 mm/min, wówczas w zależności od obserwowanych objawów klinicznych można podejrzewać wystąpienie suchego oka.
Ze względu na łzawienie odruchowe test ten jest mało czuły. Ujemny wynik testu nie wyklucza KCS, natomiast powtarzający się dodatni wynik testu Schirmera poniżej 10 mm/ min wskazuje z dużą swoistością na ZSO.
Test z nicią fenolową – podobny do testu Schirmera I. Zastąpienie paska bibuły specjalną nicią, która mniej drażni oko, podwyższa czułość testu.
Test Schirmera-2 – Test STT-2 przeprowadza się w podobny sposób, po uprzednim znieczuleniu worka spojówkowego i rogówki środkiem miejscowo znieczulającym (np. bupiwakainą). O ile STT-1 określa całkowite wydzielanie łez, o tyle STT-2 wykonany po podaniu ś rodka znieczulającego bada tylko wydzielanie podstawowe. W praktyce okazuje się bowiem, ż e krople znieczulające miejscowo zmniejszają ilość łez wydzielanych odruchowo, choć nie eliminują łzawienia całkowicie. Za pomocą testu łzowego STT-2 uzyskuje się wyniki stanowiące ok. 50% wartości wyników uzyskanych w teście STT-1. [1,2,3,4]
Zastosowanie preparatu VisioPet w zapobieganiu upośledzenia nawilżania oczu oraz łagodzeniu objawów KCS u psów i kotów.
Preparat nawilżający i łzozastępczy Visiopet jest produktem złożonym. W jego składzie istotną rolę odgrywają dwie substancje czynne: palmitoetylenoamid (PEA) oraz kwas hialuronowy. PEA jest naturalną substancją lipidową oka, której ilość zmienia się w przebiegu procesów chorobowych, celem ochrony gałki ocznej [13-18]. Funkcja PEA polega między innymi na hamowaniu degranulacji komórek tucznych (tzw. Mechanizm ALIA) [19-22]. Dzięki kompleksowi beta-cyklodekstryny PEA utrzymuje się w środowisku wodnym i uwalnia w warstwie lipidowej filmu łzowego oraz nabłonku rogówki. Palmitoetylenoamid ma wyraźne działanie łagodzące, dzięki przywróceniu homeostazy oka [13-26].
Drugi, istotny czynnik preparatu VisioPet - Kwas hialuronowy jest fizjologicznym polimerem będącym naturalnym składnikiem tkanek, w tym również tkanek oka. [31-34] Posiada on zdolność do wiązania się z powierzchnią rogówki oraz zatrzymywania dużych ilości wody, co jest istotnym czynnikiem regulującym nawilżenie i ochronę tkanek gałki ocznej. [31-33]
Potwierdzone naukowo cechy kwasu hialuronowego, wykorzystywane w leczeniu KCS to między innymi: optymalne właściwości lepko-sprężyste zabezpieczające oko w trakcie mrugania [37] oraz silne właściwości higroskopijne (zatrzymuje do 100% wody). Jako doskonały humektant zapewnia odpowiednie nawilżanie oraz smarowanie zarówno rogówki, jak i spojówki. Jego zastosowanie stymuluje regenerację nabłonka rogówki między innymi poprzez optymalizację wiązania warstwy wodnej filmu łzowego z nabłonkiem rogówki [31] oraz stabilizację przedrogówkowego filmu łzowego w skutek odbudowy warstwy śluzowej PFŁ [34-37].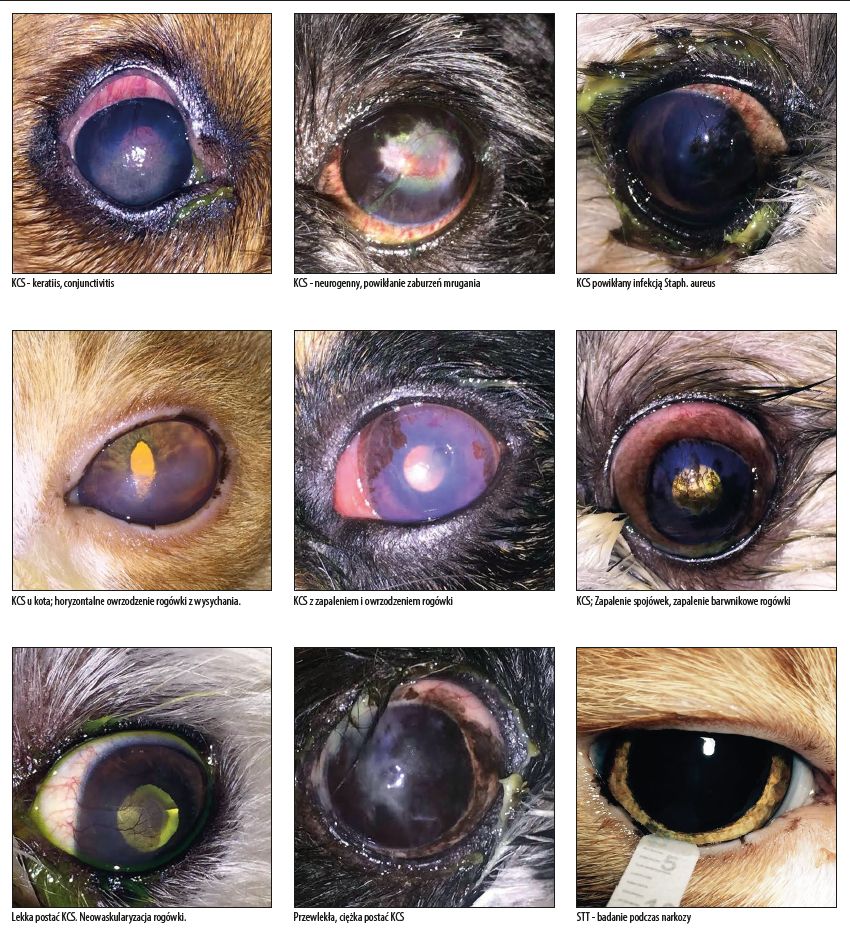
Ocena kliniczna preparatu VisioPet
Preparat VisioPet był zastosowany przez autora w przypadku 106 psów i 58 kotów.
W przypadku 70 pacjentów (40 psy i 30 kotów) preparat zastosowano podczas znieczulenia ogólnego, w celu zapobieżenia objawom suchego oka, wywołanym eliminacją odruchu mrugania i następowym upośledzeniem rozprowadzania PFŁ. Preparat VisioPet podawano po intubacji (średnio 15-20 minut po premedykacji).
Dla porównania wykorzystano grupę 40 pacjentów (20 psów i 20 kotów), którym podczas narkozy nie podawano żadnych preparatów łzozastępczych. U wszystkich pacjentów stosowano ten sam schemat anestetyczny obejmujący premedykację dexmedetomidyną, ketaminą i butorfanolem, w dawce dostosowanej do wagi ciała. U części pacjentów zastosowano dodatkową sedację dożylną propofolem. Znieczulenie ogólne prowadzono przy użyciu par izofluranu.
U wszystkich pacjentów wykonywano pełne badanie okulistyczne obejmujące min. ocenę stanu rogówki przy użyciu barwnika fluoresceinowego oraz ocenę przerwania filmu łzowego przy użyciu barwnika fluoresceinowego - FBUT (fluoresceine break-up time), a także test Schirmera.
Badanie przeprowadzano trzykrotnie – przed premedykacją; po około 30 minutach, już w trakcie trwania narkozy oraz po kolejnych 90 minutach (już po wybudzeniu pacjenta).
Do badania zakwalifikowano jedynie zwierzęta o prawidłowym obrazie klinicznym i prawidłowych wynikach testów Schirmera (powyżej 15 mm/min) podczas pierwszego badania.
W przypadku wszystkich pacjentów (psów i kotów), u których nie zastosowano preparatu łzozastepczego, w badaniu podczas narkozy (w ok. 30 minut po pierwszym badaniu) stwierdzono wyraźne wysychanie powierzchni oka z uszkodzeniem struktury PFŁ (ubytki w filmie łzowym, szczególnie w centrum kopuły rogówki). Wyniki testu Schirmera wahały się pomiędzy 7-12 mm/min u psów oraz 3–10 mm/min u kotów.
Trzecie badanie wykazało poprawę stanu PFŁ, a co za tym idzie rogówki oraz wyraźną poprawę w wynikach badania FBUT i teście Schirmera. Wyniki STT wahały się pomiędzy 14–18 mm/min u psów oraz 10–20 mm/min u kotów.
Badanie podczas narkozy u psów, którym podano preparat VisioPet, wykazało wyniki STT w zakresie 8–15 mm/min. U kotów wyniki wahały się między 7-13 mm/min.
W ostatnim badaniu, po około 90 minutach od premedykacji, a już po wybudzeniu zwierząt z narkozy test Schirmera wykazał odpowiednio dla psów i kotów: 14–20 mm/min oraz 10-18 mm/min.
Przeprowadzone badanie potwierdziło widoczny wpływ narkozy na stan przedrogówkowego filmu łzowego u zwierząt (szczególnie u kotów) poddawanych znieczuleniu ogólnemu oraz pozytywny wpływ zastosowanego preparatu.
Szczególnym atutem preparatu, o którym należy wspomnieć w tym kontekście jest fakt, iż krople znajdują się w niewielkich, zamykanych fiolkach, których zawartość może być szybko zużyta. W przypadku innych preparatów łzozastepczych, sprzedawanych w większych opakowaniach po około 10–15ml istnieje znaczące ryzyko kontaminacji zawartości butelki i konieczność jej wymiany.
Kolejną grupę zwierząt, u których testowano preparat Visiopet stanowiły zwierzęta (20 psów i 14 kotów) o nieznacznym stopniu podrażnienia spojówek, bez towarzyszących zaburzeń nawilżania oczu. W przypadku wszystkich pacjentów krople używano w monoterapii 2 razy na dobę. Ocena kontrolna po około 14–21 dniach stosowania preparatu Visiopet, wykazała poprawę kliniczną u 60% leczonych zwierząt. Skojarzone działanie PEA i kwasu hialuronowego w preparacie Visio- Pet pozwoliło na zauważalne zmniejszenie przekrwienia naczyń krwionośnych spojówki gałkowej i powiekowej, eliminację objawu mrużenia powiek oraz ograniczenie ilości wysięku zasychającego w przynosowym kącie powiekowym.
Ostatnią ocenianą grupą były psy i koty (46/14) o różnym stopniu nasilenia syndromu suchego oka (KCS). Znalazły się w niej m.in. zwierzęta z problemami o podłożu neurogennym, uwarunkowanym rasą, z powikłaniami przewlekłych infekcji bakteryjnych oraz wirusowych worka spojówkowego. W ocenie skuteczności preparatu nie brano pod uwagę etiologii i nasilenia problemu. Wielu spośród leczonych zwierząt zalecono leczenie przyczynowe (antybiotyki, cyklosporyna i inne), zaś preparat Visiopet stanowił uzupełnienie terapii. Zaobserwowano, że szczególnie w przypadkach o umiarkowanym stopniu nasilenia, włączenie preparatu do schematu leczenia, przy dawkowaniu 2–4 razy na dobę przynosi zauważalną poprawę (86% przypadków). W przypadkach ciężkich skuteczność była niższa, ale również zauważalna.
W świetle przeprowadzonej oceny klinicznej, w opinii autora, preparat VisioPet jest użytecznym narzędziem w leczeniu zapaleń spojówki i syndromu suchego oka. Doskonale nadaje się również do zastosowania podczas przygotowań do znieczulenia ogólnego.
Piśmiennictwo:
- David J. Maggs, Paul E. Miller, Ron Ofri – Okulistyka Weterynaryjna Slattera – Elsevier Urban/Partner 2008r.
- Dr n. med. Jarosław Marek – Postępowanie lekarskie w zespole suchego oka - Firma Agencyjno-Wydawnicza LekSeek Polska Sp. z o.o 2005r.
- Kirk N.Gelatt - Essentials of Veterinary Ophthalmology Thd edn. Wiley Blackwell 2014 r.
- Sally M. Turner – Okulistyka – Elsevier Urban/Partner 2008r.
- Anna Zaleska-Żmijewska - Wpływ przewlekłego leczenia przeciwjaskrowego na powierzchnię gałki ocznej i leczenie operacyjne – Okulistyka kwartalnik medyczny ISSN 1505- 2753
- Kirk N.Gelatt, Janice P.Gelatt – Veterinary Ophthalmic Surgery – saunders Elsevier 2011
- Barabino S, et al. Odporność powierzchni oka: mechanizmy homeostatyczne oraz ich zaburzenia w chorobach suchego oka. Prog. Retin Eye Res. 2012; 31(3): 271-85 (Kod. 18663)
- Gilger BC. Immunologia powierzchni oka. Vet Clin North Am Small Anim Pract. 2008;38(2):223-31 (Kod. 18607)
- Plummer CE. Zaczerwienione oko. Drzewo diagnostyczne. NAVC Clinician’s Brief. Listopad 2011:34-35 (Kod. 16849)
- Maggio F, Pizzirani S. Patologia filmu łzowego w schorzeniach rogowki psow i kotow. Część 1. Wiadomości na temat fizjologii. Weterynaria. 2009, 23(5): 35-51 (Kod. 17297)
- Crispin SM. Uwagi na temat oftalmologii weterynaryjnej. Blackwell Science 2005, Oxford, Zjednoczone Krolestwo (Kod. 18760)
- Zoukhri D. Wpływ zapalenia na funkcjonowanie gruczołu łzowego. Exp Eye Res. 2006 May;82(5):885-98 (Kod. 18726)
- Chen J, et al. Odkrycia na temat układu endokannabinoidowego w tkankach ludzkiego oka: wpływ na jaskrę. Biochem Biophys Res. Commun. 2005; 330(4):1062-7 (Kod. 11871)
- Straiker A, et al. Receptory kannabindoidowe B1 oraz ligandy w siatkowce oka kręgowcow: lokalizacja oraz funkcja endogennego systemu sygnalizacyjnego. Proc Natl Acad Sci U S A. 1999; 96(25):14565-70 (Cod. 7721)
- Grillo SL, et al. Zastrzyki z N-fenyloetyloaminą o przedłużonym działaniu zwiększającą swoj poziom w tkankach oraz te z lipidami acetyloetanolamidowymi. Drug Des Devel 2013; 7:747-52 (Cod. 18784)
- Matias I, et al. Zmiany poziomow endokannabindoidow oraz palmitoetylenoamidu w tkankach oka u pacjentow z retinopatią cukrzycową oraz degradacją plamki źołtej związaną ze starzeniem. Prostaglandins Leukot Essent Fatty Acids. 2006; 75(6):413-8 (Cod. 12939)
- Esposito E, Cuzzocrea S. Palmitoetylenoamid jako nowy możliwy sposob leczenia zapalenia związanego z urazem. Mini Rev Med. Chem. 2013;13(2):237-55 (Cod. 16316)
- Re G, et al. Palmitoetylenoamid, endokannabindoidy oraz powiązane związki kannabimimetyczne dla zabezpieczenia przed zapaleniem tkanek oraz bolem: Potencjalne możliwości wykorzystania u zwierząt towarzyszących. Vet J. 2007; 173(1):23-32 (Cod.11977)
- Aloe L, et al. Propozycja mechanizmu autakoidalnego sterującego zachowaniem komorek tucznych. Agents Actions. 1993;39 Spec No:C145-7 (Cod. 7208)
- Facci L, et al. Komorki tuczne z peryferycznym receptorem kannabinoidowym o rożnej wrażliwości na anamidy oraz palmityloetyloamidy. Proc Natl Acad Sci 1995; 92(8):3376- 80 (Cod. 7354)
- Cerrato S, et al. Skutki jakie wywierają palmityloetyloamidy na immunologicznie indukowaną histaminę, wydzielanie PGD2 oraz czynnika TNFa przez komorki tuczne skory psa. Vet Immunol Immunopathol. 2010;133(1): 9-15 (Cod. 14628)
- Cantarella G, et al. Endokannabindoidy hamują wydzielanie czynnika wzrostu nerwow poprzez aktywowane zapaleniem komorki tuczne. Biochem Pharmacol. 2011; 82(4):380- 8 (Cod. 15115)
- Kumar A, et al. Skutki jakie wywierają palmityloetyloamidy na przepływ cieczy wodnistej oka. Invest Ophthalmol Vis Sci. 2012; 53(8):4416-25 (Cod. 17308)
- Gagliano C, et al. Hipotensja oczna w wyniku podania doustnie palmityloetyloamidow: proba kliniczna. Invest Ophthalmol Vis Sci. 2011;52(9):6096-100 (Cod. 16539)
- Pescosolido N, et al. Wpływ palmityloetyloamidu (PEA) po zabiegu nacięcia tęczowki laserem neodymowym YAG: eksperymentalne badanie kliniczne oraz krytyczny przegląd literatury. J Ocul Pharmacol Ther. 2011;27(6):629-35 (Cod. 16548)
- Strobbe E, et al. Skuteczność palmityloetyloamidu w przypadku dysfunkcji komorek środbłonka u pacjentow z nadciśnieniem ocznym: randomizowana podwojnie ślepa proba z kontrolowanym placebo w badaniu krzyżowym. Invest Ophthalmol Vis Sci.2013;54(2):968-73 (Cod. 18095)
- Stella VJ, He Q. Cyklodekstryny. Toxicol Pathol. 2008;36(1):30-42 (Cod. 18644) Loftsson T, et al. Cyklodekstryny jako nośniki lekow. Expert Opin Drug Deliv. 2005 Mar;2(2):335-51 (Cod. 18645)
- Brewster ME, Loftsson T. Cyclodekstryny jako solublizatory farmaceutyczne. Adv Drug Deliv Rev. 2007;59(7):645-66 (Cod.18646)
- Davis ME, Brewster ME. Farmaceutyka oparta na cyklodekstrynie: przeszłość, teraźniejszość oraz przyszłość. Nat Rev Drug Discov. 2004;3(12):1023-35 (Cod. 18647)
- Rah MJ. Przegląd hialuronianu oraz jego zastosowania oftalmologiczne. Optometry 2011; 82(1): 38-43 (Cod. 18685)
- Hollyfield JG, et al. Hialuronian w macierzy interfotoreceptorowej oka: rożnice gatunkowe w zawartości, rozprzestrzenianiu, wiązaniu ligandow oraz degradacji. Exp Eye Res. 1998;66(2):241-8 (Cod. 18752)
- Robert L, et al. Biologiczny wpływ hialuronianu na tkankę łączną, oko, skorę, ściany żył. Rola jaką odgrywa w procesie starzenia. Pathol Biol (Paris). 2010;58(3):187-98 (Cod. 18764)
- Kashiwagi Y, et al. Produkcja hialuronianu oraz ekspresja syntazy hialuronianu w trzech szczepach komorek pochodzących z ludzkiej siatkowki. Jpn J Ophthalmol. 2011;55(6):660-9 (Cod. 18747)
- Maggio F, Pizzirani S. Patologia filmu łzowego w schorzeniach rogowki psow i kotow Część 2. Symptomy kliniczne, diagnoza i terapia. Weterynaria. 2009; 23(5): 55-70 (Cod. 17949)
- Williams DL, Mann BK. Ulepszone hydrożele z usieciowanym HA w leczeniu objawow suchego oka u psow. Int J Biomater. 2013;2013:460437 (Cod. 18668)
- Grahn BH, Storey ES. Stymulatory łez oraz substancje naśladujące działanie łez. Vet Clin North Am Small Anim Pract. 2004; 34(3):739-53 (Cod. 17298)
