Do bezpłatnej dostawy brakuje -,--
Podsumowanie zamówienia
Suma Netto 0,00 zł Cena po zalogowaniu
Suma Brutto 0,00 zł Cena po zalogowaniu
Cena uwzględnia rabaty
- 🎯 Promocje
- 📋 Zapytania
-
🩺 Wyposażenie
- Aparaty do anestezji
- Aparaty do gazometrii
- Badanie słuchu u zwierząt
- Ciśnieniomierze weterynaryjne
- Czujniki, adaptery SpO2 weterynaryjne
- Dopplery weterynaryjne
- EKG weterynaryjne
- Endoskopy weterynaryjne
- Fiberoskopy weterynaryjne
- Kamera do badania dna oka zwierząt
- Lasery weterynaryjne
- Mikroskopy weterynaryjne
- Weterynaryjne monitory pacjenta
- Oftalmoskopy weterynaryjne
- Otoemisja akustyczna
- Otoskopy weterynaryjne
- Procesory i kamery endoskopowe
- RTG weterynaryjne
- Stetoskopy weterynaryjne
- Termometry weterynaryjne
- Tomografy weterynaryjne
- USG weterynaryjne
- Video endoskopy weterynaryjne
- Video otoskopy weterynaryjne
- Video printery weterynaryjne
- Wagi weterynaryjne
- Wykrywacze rui
- Elektrochirurgia wetarynaryjna
- Igły chirurgiczne
- Implanty i instrumentaria weterynaryjne
- Lupy okularowe
- Mikroskopy operacyjne
- Narzędzia chirurgiczne
- Ochrona pooperacyjna zwierząt
- Podkłady, serwety operacyjne
- Ssaki weterynaryjne
- Aparaty combi
- Aparaty do elektroterapii
- Aparaty do kriochirurgii
- Aparaty do krioterapii
- Aparaty do laseroterapii
- Aparaty do magnetoterapii
- Aparaty do stymulacji elektromagnetycznej
- Aparaty do stymulacji kawitacyjnej
- Aparaty do terapii radiofalowej
- Aparaty do ultradźwięków
- Aparaty do znieczuleń
- Bieżnie
- Fale uderzeniowe
- Fale uderzeniowe i laser wysokoenergetyczny combi
- Fale uderzeniowe skupione
- Hipotermia
- Identyfikacja zwierząt
- Klatki dla zwierząt
- Lampy bakteriobójcze przepływowe
- Lampy bakteriobójcze dwufunkcyjne
- Lampy bezpośredniego naświetlania
- Lampy operacyjne
- Lampy zabiegowe
- Lasery niskoenergetyczne
- Lasery wysokoenergetyczne
- Magnetoterapia
- Maty grzewcze
- Meble weterynaryjne
- Modele anatomiczne zwierząt
- Narzędzia ortopedyczne
- Nosze weterynaryjne
- Odzież weterynaryjna
- Pojemniki medyczne
- Pomiary tensometryczne
- Pompy artroskopowe
- Pompy infuzyjne
- Sprzęt rehabilitacyjny
- Stoły operacyjne
- Stoły zabiegowe
- Super indukcyjna stymulacja
- Taborety weterynaryjne
- Urządzenia termiczne
- Wózki i stoliki narzędziowe
-
🔬 Laboratorium
- Autoklawy weterynaryjne
- Biochemia mokra w weterynarii
- Biochemia sucha w weterynarii
- Analizatory do badania moczu
- Analizatory do hormonów
- Analizatory elektrolityczne
- Analizatory hematologiczne
- Cieplarki weterynaryjne
- Hemoglobinometry weterynaryjne
- Laboratoryjne łaźnie wodne
- Meble laboratoryjne
- Mieszadła laboratoryjne
- Odczynniki dodatkowe
- Pipety weterynaryjne
- TESTY NA COVID-19
- Wirówki
- Pozostałe
-
🏭 Dostawcy
- ALPHA DIAGNOSTICS
- AS RTG
- AXONLAB
- BESTOMED
- BIOMAG VET
- BIOMAXIMA
- BTL
- CORMAY DIAGNOSTICS
- DELTA OPTICAL
- DOGS PLATE
- EICKEMEYER
- FIT-VET
- FUTURE DENT
- FUTURE TERRA VETERINARY
- GŁOWACKI VET
- ICB PHARMA
- IDEXX
- INTERMECH
- KARL STORZ
- MEDICA 91
- MEDINCO WETERYNARIA
- MODER ELECTRO
- PROFILAB
- RENTGEN-SERWIS
- RICARE
- RIVBIO
- SEAMATY
- SONOLIFE
- SY-MED
- TECHMEDICA
- TECHNOMED
- ULTRASONOGRAFY24
- VARIMEX-VALVES
- VETISS
- 📆 WET Wydarzenia
- 📑 Przetargi
- 🆕 Nowości
- 📞 Kontakt
Odtrutka na toksynę botulinową
2014-06-06 09:27:00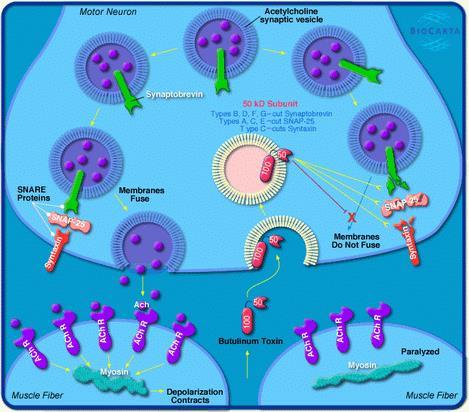
Naukowcy z University of California Irvine oraz Institute for Toxicology at Germany’sHannover Medical School odkryli strukturę przestrzenną składnika białkowe gobotuliny, który odgrywa kluczową rolę w jej transporcie z przewodu pokarmowego do krwi. Dzięki temu możliwe będzie zapobieganie wchłanianiu toksyny, a tym samym występowaniu poważnych skutków neurotoksycznych w organizmie.
Za produkcję botuliny, zwanej inaczej jadem kiełbasianym, odpowiadają bakterie z rodzaju C. botulinum. Są one laseczkami rozwijającymi się jedynie w warunkach beztlenowych. Ich przetrwalniki występują powszechnie w glebie. Wytwarzana przez bakterie toksyna jest jedną z najsilniejszych trucizn znanych człowiekowi. Źródłem zatruć może być przeterminowana lub niewłaściwie przechowywana pasza.
Badania mechanizmu działania botuliny wykazały, że wpływa ona na płytkę nerwowo–mięśniową. Łączy się ze specyficznym białkiem części presynaptycznej – synaptograminą - co powoduje hamowanie uwalniania acetylocholiny i porażenie mięśni. Spośród siedmiu odmiennych antygenowo serotypów toksyny oznaczonych literami od A do G, tylko serotypy A, B i E wywołują objawy botulizmu. Stałymi objawami są zaburzenia widzenia, suchość w jamie ustnej i zaparcia. Ponadto mogą pojawiać się nudności, wymioty, bóle brzucha oraz osłabienie różnych grup mięśni, w ciężkich przypadkach prowadzące do niewydolności oddechowej, zachłystowego zapalenia płuc i zatrzymania akcji serca.
Wykazano, że toksyna botulinowa jest uwalniania łącznie z białkami pomocniczymi, tworząc kompleksy prekursorowe (ang. progenitor toxin complexes –PTCs). Prowadzący badania prof. Rongsheng Jin z University of California Irvinei Andreas Rummel z Institute for Toxicology at Germany’s Hannover Medical School stworzyli trójwymiarowy model PTCs toksyny o serotypie A (L-PTC/A). Składa się on z 14 podjednostek o łącznej masie atomowej ~760 kDa.
Używając rentgenografii strukturalnej i mikroskopii elektronowej, naukowcy odkryli, że L-PTC/A jest podzielony na dwa, niezależne strukturalnie i czynnościowo fragmenty. Fragment o masie 290 kDa, utworzony przez 2 podjednostki, chroni toksynę botulinową, natomiast fragment o masie 470 kDa, składający się z 12 podjednostek, ułatwia jej absorpcję w kwaśnym środowisku przewodu pokarmowego. Za proces wchłaniania odpowiada 9 swoistych miejsc wiążących, które leżą na tym fragmencie i wchodzą w poliwalentne interakcje z receptorami glikoproteinowymi na komórkach nabłonkowych jelita.
Badania przeprowadzone na myszach wykazały, że monosacharyd IPTG może blokować transport toksyny przez ścianę przewodu pokarmowego, a tym samym uniemożliwiać przeniknięcie trucizny do krwiobiegu. Podobny efekt hamujący uzyskano in vitro, wykonując test z agonistami receptora glikoproteinowego.
Opracowanie struktury przestrzennej kompleksu prekursorowego botuliny daje szansę na wprowadzenie na rynek środka farmaceutycznego, który ograniczy szkodliwy wpływ toksyny na organizm po spożyciu zakażonego pokarmu lub nawet całkowicie zapobiegnie rozwojowi objawów chorobowych.
Źródło: https://medtube.pl/tribune-pl/2013/10/zapobieganie-zatruciu-botulina-dzieki-specyficznej-strukturze-3-d/
