Do bezpłatnej dostawy brakuje -,--
Podsumowanie zamówienia
Suma Netto 0,00 zł
Suma Brutto 0,00 zł
Cena uwzględnia rabaty
- 🎯 Promocje
- 📋 Zapytania
-
🩺 Wyposażenie
- Aparaty do anestezji
- Aparaty do gazometrii
- Badanie słuchu u zwierząt
- Ciśnieniomierze weterynaryjne
- Czujniki, adaptery SpO2 weterynaryjne
- Dopplery weterynaryjne
- EKG weterynaryjne
- Endoskopy weterynaryjne
- Fiberoskopy weterynaryjne
- Kamera do badania dna oka zwierząt
- Lasery weterynaryjne
- Mikroskopy weterynaryjne
- Weterynaryjne monitory pacjenta
- Oftalmoskopy weterynaryjne
- Otoemisja akustyczna
- Otoskopy weterynaryjne
- Procesory i kamery endoskopowe
- RTG weterynaryjne
- Stetoskopy weterynaryjne
- Termometry weterynaryjne
- Tomografy weterynaryjne
- USG weterynaryjne
- Video endoskopy weterynaryjne
- Video otoskopy weterynaryjne
- Video printery weterynaryjne
- Wagi weterynaryjne
- Wykrywacze rui
- Elektrochirurgia weterynaryjna
- Igły chirurgiczne
- Implanty i instrumentaria weterynaryjne
- Lupy okularowe
- Mikroskopy operacyjne
- Narzędzia chirurgiczne
- Ochrona pooperacyjna zwierząt
- Podkłady, serwety operacyjne
- Ssaki weterynaryjne
- Aparaty combi
- Aparaty do elektroterapii
- Aparaty do kriochirurgii
- Aparaty do krioterapii
- Aparaty do laseroterapii
- Aparaty do magnetoterapii
- Aparaty do stymulacji elektromagnetycznej
- Aparaty do stymulacji kawitacyjnej
- Aparaty do terapii radiofalowej
- Aparaty do ultradźwięków
- Aparaty do znieczuleń
- Bieżnie
- Fale uderzeniowe
- Fale uderzeniowe i laser wysokoenergetyczny combi
- Fale uderzeniowe skupione
- Hipotermia
- Identyfikacja zwierząt
- Klatki dla zwierząt
- Lampy bakteriobójcze przepływowe
- Lampy bakteriobójcze dwufunkcyjne
- Lampy bezpośredniego naświetlania
- Lampy operacyjne
- Lampy zabiegowe
- Lasery niskoenergetyczne
- Lasery wysokoenergetyczne
- Magnetoterapia
- Maty grzewcze
- Meble weterynaryjne
- Modele anatomiczne zwierząt
- Narzędzia ortopedyczne
- Nosze weterynaryjne
- Odzież weterynaryjna
- Pojemniki medyczne
- Pomiary tensometryczne
- Pompy artroskopowe
- Pompy infuzyjne
- Sprzęt rehabilitacyjny
- Stoły operacyjne
- Stoły zabiegowe
- Super indukcyjna stymulacja
- Taborety weterynaryjne
- Urządzenia termiczne
- Wózki i stoliki narzędziowe
-
🔬 Laboratorium
- Autoklawy weterynaryjne
- Biochemia mokra w weterynarii
- Biochemia sucha w weterynarii
- Analizatory do badania moczu
- Analizatory do hormonów
- Analizatory elektrolityczne
- Analizatory hematologiczne
- Cieplarki weterynaryjne
- Hemoglobinometry weterynaryjne
- Laboratoryjne łaźnie wodne
- Meble laboratoryjne
- Mieszadła laboratoryjne
- Odczynniki dodatkowe
- Pipety weterynaryjne
- TESTY NA COVID-19
- Wirówki
- Pozostałe
-
🏭 Dostawcy
- ALPHA DIAGNOSTICS
- AS RTG
- AXONLAB
- BESTOMED
- BIOMAG VET
- BIOMAXIMA
- BTL
- CORMAY DIAGNOSTICS
- DELTA OPTICAL
- DOGS PLATE
- EICKEMEYER
- FIT-VET
- FUTURE DENT
- FUTURE TERRA VETERINARY
- GŁOWACKI VET
- ICB PHARMA
- IDEXX
- INTERMECH
- KARL STORZ
- MEDICA 91
- MEDINCO WETERYNARIA
- MODER ELECTRO
- PROFILAB
- RENTGEN-SERWIS
- RICARE
- RIVBIO
- SEAMATY
- SONOLIFE
- SY-MED
- TECHMEDICA
- TECHNOMED
- ULTRASONOGRAFY24
- VARIMEX-VALVES
- VETERINARY EYE TREATMENT
- VETISS
- 📆 WET Wydarzenia
- 📑 Przetargi
- 🆕 Nowości
- 📞 Kontakt
Antybiotyk programowany na lekooporne patogeny
2014-10-06 10:08:00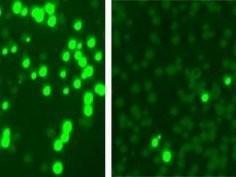
Naukowcy z Rockefeller University zaprezentowali programowalny antybiotyk, który selektywnie obiera na cel szkodliwe mikroorganizmy, zwłaszcza te z genami lekooporności, nie szkodząc przy okazji łagodnym bakteriom.
Podczas eksperymentów udało nam się poinstruować enzym bakteryjny [nukleazę DNA] Cas9, by znajdował określoną sekwencję DNA i ją wycinał. Wybiórcze podejście pozostawia nietknięty zdrowy mikrobiom. Badania wykazały, że dzięki temu da się kontrolować lekooporność i zapobiegać wtórnym infekcjom, eliminując dwa poważne problemy, związane z terapią klasycznymi antybiotykami - wyjaśnia Luciano Marraffini.
Enzym Cas9 to część szlaku zgrupowanych, regularnie rozmieszczonych krótkich sekwencji palindromowych CRISPR (ang. clustered regularly interspaced short palindromic repeats), czyli systemu obrony bakterii przed egzogennymi elementami genetycznymi, np. bakteriofagami. CRISPR składa się z prostych powtórzeń (ang. direct repeats), rozdzielonych unikatowymi sekwencjami łącznikowymi (ang. spacer). Sekwencje łącznikowe zawierają fragmenty DNA fagów lub plazmidów; w 2007 r. wykazano doświadczalnie, że kawałki DNA fagów, które podczas infekcji fagami zostały włączone do CRISPR jako nowe sekwencje łącznikowe, zapewniają komórkom trwałą odporność na zakażenia konkretnym bakteriofagiem. Enzymy związane z CRISPR wykorzystują sekwencje łącznikowe do identyfikowania i niszczenia najeźdźców.
Mając to wszystko na uwadze, Amerykanie przygotowali sekwencje łącznikowe odpowiadające genom konkretnych bakterii i razem z genem Cas9 wprowadzili je do komórek. Resztę pracy wykonywała sama komórka. W zależności od lokalizacji celu, Cas9 może albo uśmiercić całą komórkę, albo tylko wyeliminować wybrany przez naukowców gen.
Wcześniej wykazaliśmy, że jeśli Cas9 jest zaprogramowany, by atakować cel z bakteryjnego genomu, zabije bakterię. Bazując na tych pracach, wybraliśmy celowane sekwencje, które pozwoliły nam wybiórczo uśmiercić szczep bakterii z mieszanej populacji - wyjaśnia David Bikard.
W początkowych eksperymentach zespół Bikarda wybrał gronkowca złocistego (Staphylococcus aureus) opornego na kanamycynę. Terapia z wykorzystaniem Cas9 programowanego na fragment genu oporności zabiła większość lekoopornego szczepu, nie wpływając na gronkowce wrażliwe na antybiotyk.
Zabijanie bakterii to tylko jedna z opcji. W drugiej serii eksperymentów akademicy skierowali bowiem Cas9 na kodujące oporność na tetracyklinę plazmidy wielolekoopornego gronkowca złocistego. W wyniku takiego zabiegu oporne komórki stały się wrażliwe na tetracyklinę. Zaobserwowano też ciekawe zjawisko u wrażliwych komórek, które wydawały się "zaszczepione" i nie wychwytywały plazmidów kodujących oporność.
W ostatniej serii eksperymentów Chad Euler potwierdził na myszach wcześniejsze wyniki z badań laboratoryjnych. Gryzoniom ogolono grzbiety i zakażono skórę opornymi na kanamycynę gronkowcami złocistymi.
Choć wyniki są obiecujące, należy ulepszyć system dostawy. Do dostarczania zaprogramowanego Cas9 wykorzystywano fagi, ale wirusy te atakują tylko określone rodzaje komórek. Trzeba więc wynaleźć mniej wybiórczą platformę transportu.
źródło: http://kopalniawiedzy.pl/Cas9-CRISPR-antybiotyk-programowalny-komorka-Luciano-Marraffini,21149
